
lunes, 9 de junio de 2008
penta cloruro de fosforo
PCl5 [PCl4+]Cl−
A mayores concentraciones, un segundo equilibro se hace más importante:
2 PCl5 [PCl4+][PCl6−]
El catión PCl4+ y el anión PCl6− tienen geometría tetraédrica y octaédrica, respectivamente. Las estructuras para los cloruros de fósforo son invariablemente consistentes con la teoría VSEPR.
En disolvente apolares, como el CS2 y el CCl4, la estructura D3h presente en los estados líquido y gaseoso permanece intacta
Preparación
El PCl5 existe en equilibrio con el PCl3 y chlorine, a 180 °C. El porcentaje de disociación es alrededor del 40%.Debido a este equilibrio, las muestras de PCl5 a menudo contienen cloro lo que les confiere una coloración verdosa.
Hidrólisis
PCl5 + H2O → POCl3 + 2 HCl
En agua caliente, la hidrólisis produce solo ortho-phosphoric acid:
PCl5 + 4 H2O → H3PO4 + 5 HCl
LOS ATOMOS, LAS PARTICULAS Y LOS ORBITALES
El átomo
El origen de la teoría atómica se remonta a la escuela filosófica de los atomistas, en la Grecia antigua. Los fundamentos empíricos de la teoría atómica, de acuerdo con el método científico, se debe a un conjunto de trabajos hechos por Lavoiser, Proust, Richter, Dalton, Gay-Lussac y Avogadro entre muchos otros, hacia principios del siglo XIX.
Los átomos son la fracción más pequeña de materia estudiados por la química, están constituidos por diferentes partículas, cargadas eléctricamente, los electrones, de carga negativa; los protones, de carga positiva; los neutrones, que, como su nombre indica, son neutros (sin carga); todos ellos aportan masa para contribuir al peso del átomo.
Partículas
Los átomos son las partes más pequeñas de un elemento (como el carbono, el hierro o el oxígeno). Todos los átomos de un mismo elemento tienen la misma estructura electrónica (responsable esta de la gran mayoría de las características químicas), pudiendo diferir en la cantidad de neutrones (isótopos). Las moléculas son las partes más pequeñas de una sustancia (como el azúcar), y se componen de átomos enlazados entre sí. Si tienen carga eléctrica, tanto átomos como moléculas se llaman iones: cationes si son positivos, aniones si son negativos.
El mol se usa como contador de unidades, como la docena (12) o el millar (1000), y equivale a 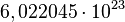 . Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar de un elemento está basada en la masa de un mol de dicho elemento). Se dice entonces que el mol es una unidad de cambio. El mol tiene relación directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el Químico y Físico italiano Carlo Amedeo Avogadro Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente, equivale al número de partículas presentes en 1 mol de dicha sustancia. Veamos:
. Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar de un elemento está basada en la masa de un mol de dicho elemento). Se dice entonces que el mol es una unidad de cambio. El mol tiene relación directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el Químico y Físico italiano Carlo Amedeo Avogadro Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente, equivale al número de partículas presentes en 1 mol de dicha sustancia. Veamos:
1 mol de glucosa equivale a 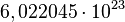 moléculas de glucosa
moléculas de glucosa
1 mol de Uranio equivale a 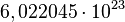 átomos de Uranio
átomos de Uranio
Dentro de los átomos, podemos encontrar un núcleo atómico y uno o más electrones. Los electrones son muy importantes para las propiedades y las reacciones químicas. Dentro del núcleo se encuentran los neutrones y los protones. Los electrones se encuentran alrededor del núcleo. También se dice que es la unidad básica de la materia con características propias. Está formado por un núcleo donde se encuentran protones.
De los átomos a las moléculas
Los enlaces son las uniones entre átomos para formar moléculas. Siempre que existe una molécula es porque ésta es más estable que los átomos que la forman por separado. A la diferencia de energía entre estos dos estados se le denomina energía de enlace.
Generalmente, los átomos se combinan en proporciones fijas para dar moléculas. Por ejemplo, dos átomos de hidrógeno se combinan con uno de oxígeno para dar una molécula de agua. Esta proporción fija se conoce como estequiometría.
Orbitales
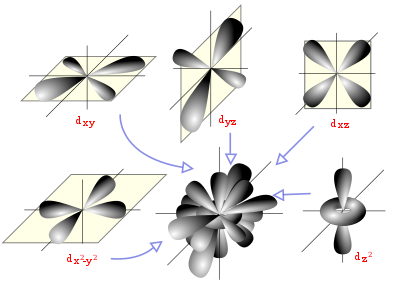
Para una descripción y comprensión detalladas de las reacciones químicas y de las propiedades físicas de las diferentes sustancias, es muy útil su descripción a través de orbitales, con ayuda de la química cuántica.
Un orbital atómico es una función matemática que describe la disposición de uno o dos electrones en un átomo. Un orbital molecular es análogo, pero para moléculas.
En la teoría del orbital molecular la formación del enlace covalente se debe a una combinación matemática de orbitales atómicos (funciones de onda) que forman orbitales moleculares, llamados así por que pertenecen a toda la molécula y no a un átomo individual. Así como un orbital atómico (sea híbrido o no) describe una región del espacio que rodea a un átomo donde es probable que se encuentre un electrón, un orbital molecular describe una región del espacio en una molécula donde es más factible que se hallen los electrones.
Al igual que un orbital atómico, un orbital molecular tiene un tamaño, una forma y una energía específicos. Por ejemplo, en la molécula de hidrógeno molecular se combinan dos orbitales atómicos uno s ocupados cada uno por un electrón. Hay dos formas en que puede presentarse la combinación de orbitales: aditiva y subtractiva. La combinación aditiva produce la formación de un orbital molecular que tiene menor energía y que tiene, aproximadamente, forma ovalada, mientras que la combinación subtractiva conduce a la formación de un orbital molecular con mayor energía y que genera un nodo entre los núcleos.
De los orbitales a las sustancias
Los orbitales son funciones matemáticas para describir procesos físicos: un orbital solo existe en el sentido matemático, como pueden existir una suma, una parábola o una raíz cuadrada. Los átomos y las moléculas son también idealizaciones y simplificaciones: un átomo sólo existe en vacío, una molécula sólo existe en vacío, y, en sentido estricto, una molécula sólo se descompone en átomos si se rompen todos sus enlaces.
En el "mundo real" sólo existen los materiales y las sustancias. Si se confunden los objetos reales con los modelos teóricos que se usan para describirlos, es fácil caer en falacias lógicas.
la quimica
Las disciplinas de la química han sido agrupadas por la clase de materia bajo estudio o el tipo de estudio realizado. Entre estas se tienen la química inorgánica, que estudia la materia inorgánica; la química orgánica, que trata con la materia orgánica; la bioquímica, el estudio de substancias en organismos biológicos; la físico-química, comprende los aspectos energéticos de sistemas químicos a escalas macroscópicas, moleculares y submoleculares; la química analítica, que analiza muestras de materia tratando de entender su composicion y estructura. Otras ramas de la química han emergido en tiempos recientes, por ejemplo, la neuroquímica que estudia los aspectos químicos del cerebro.







